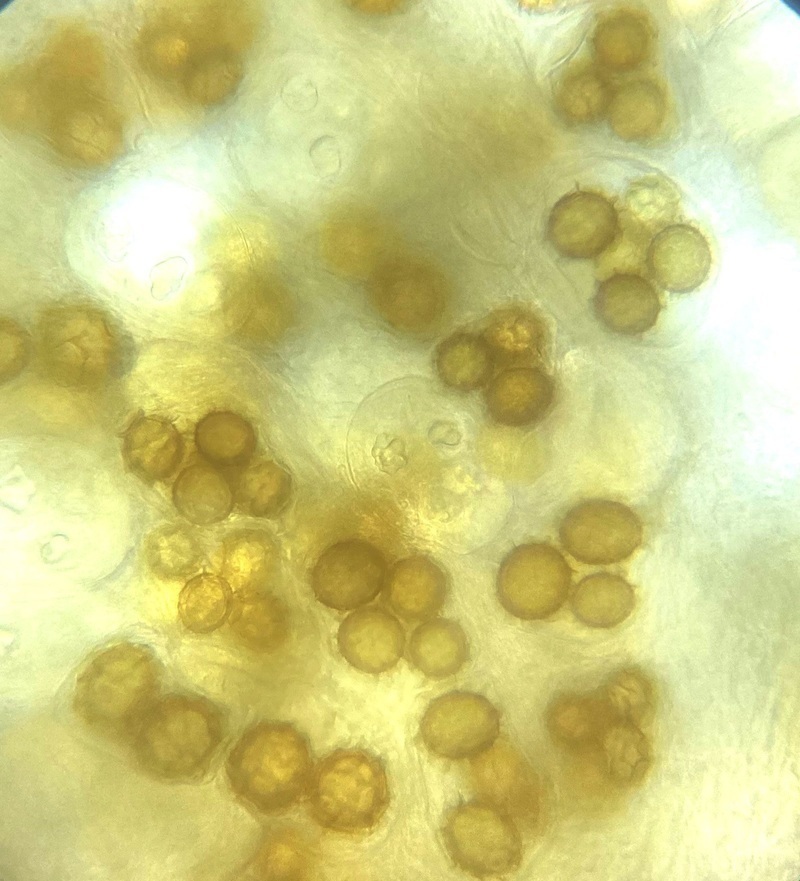
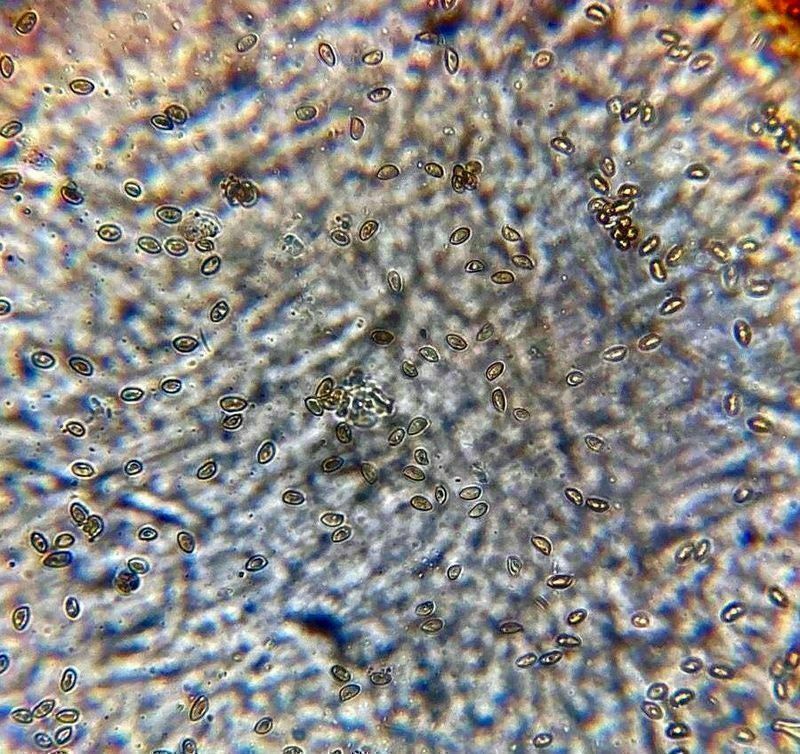
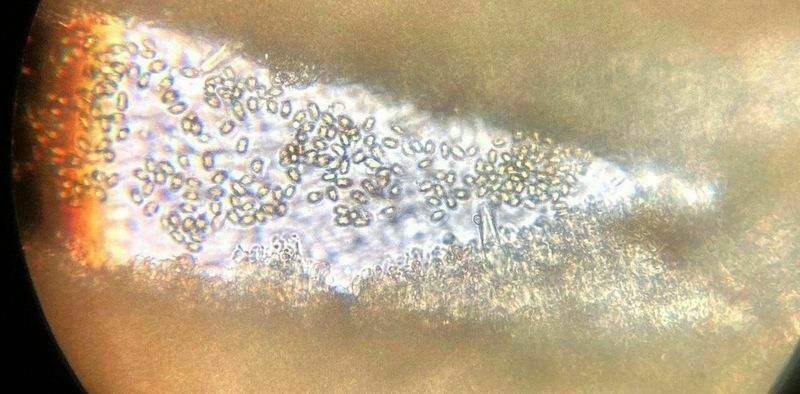
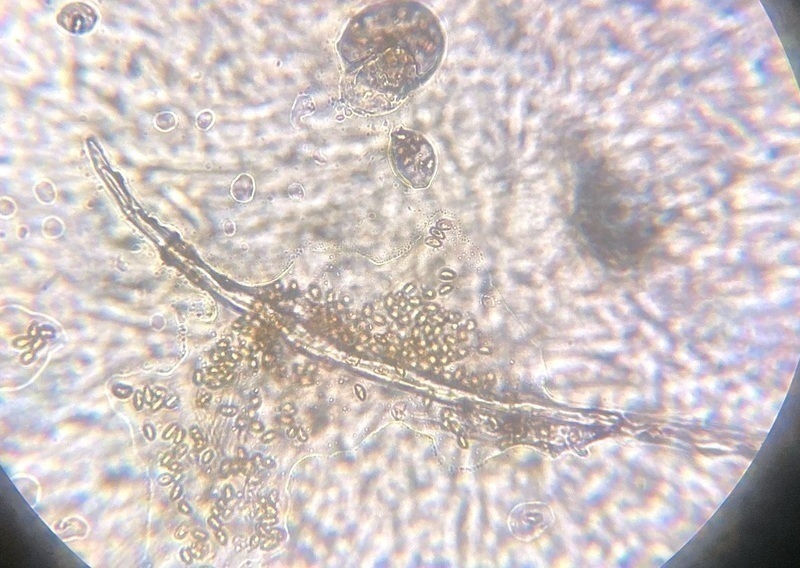
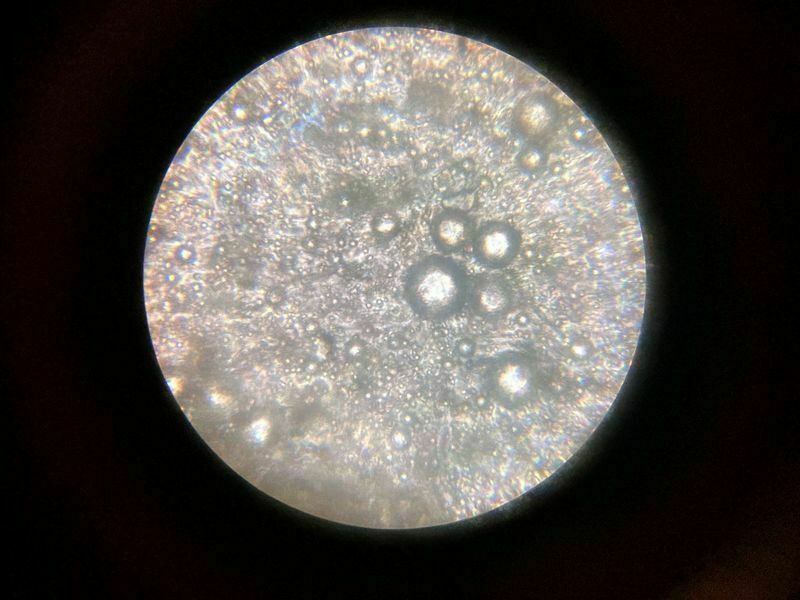
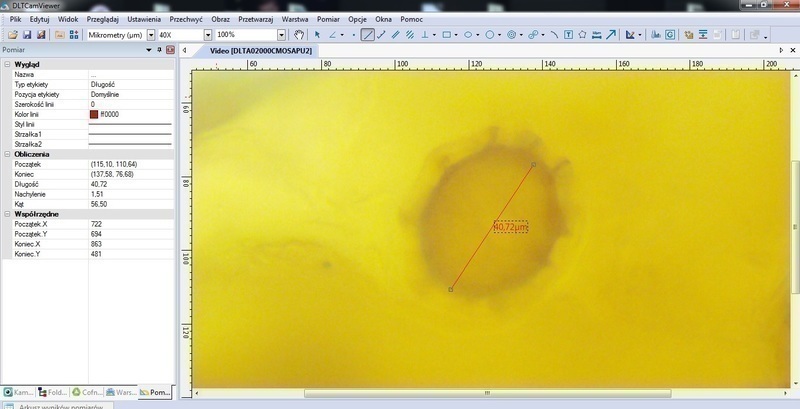
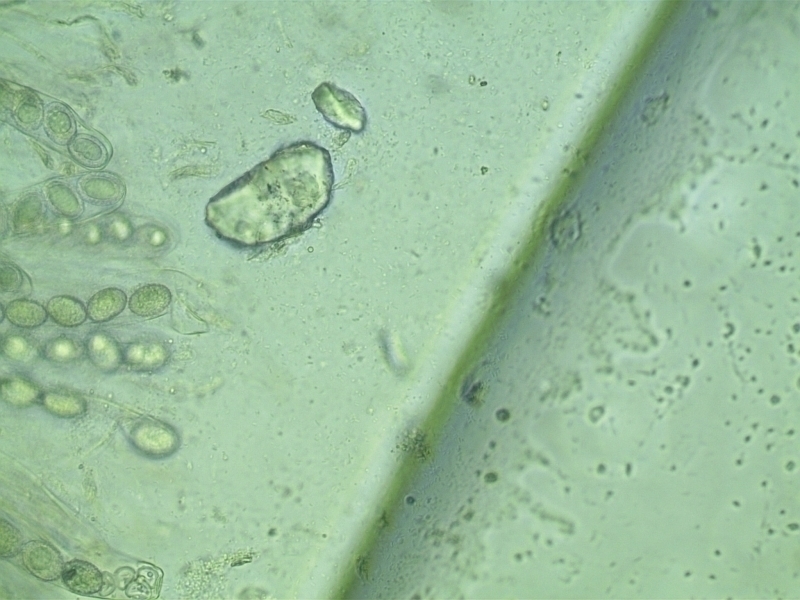
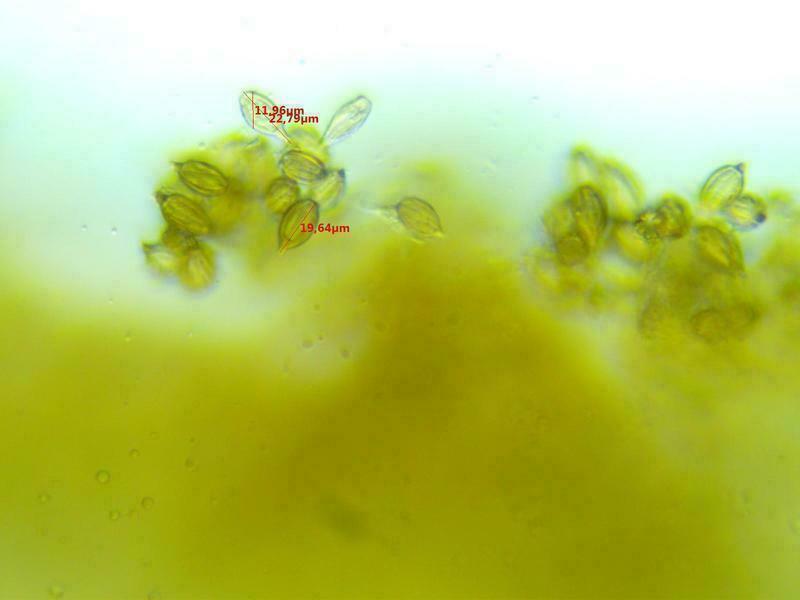
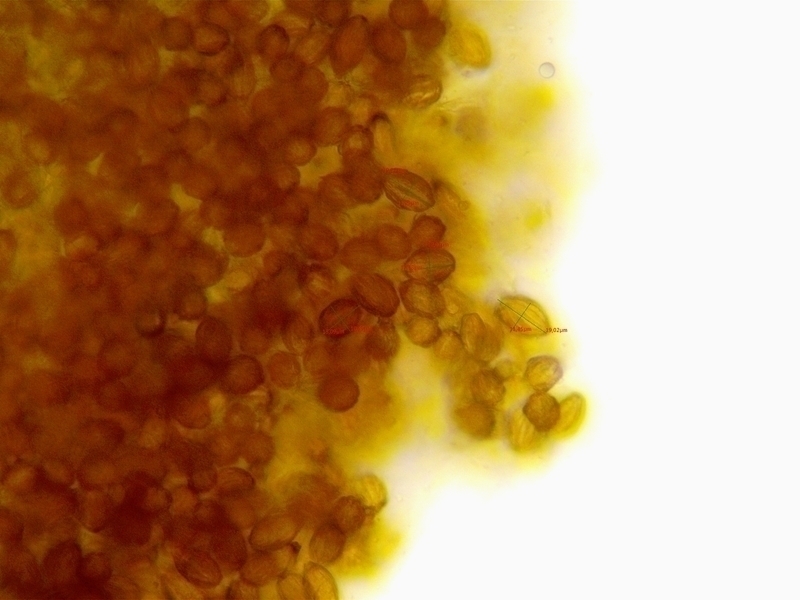
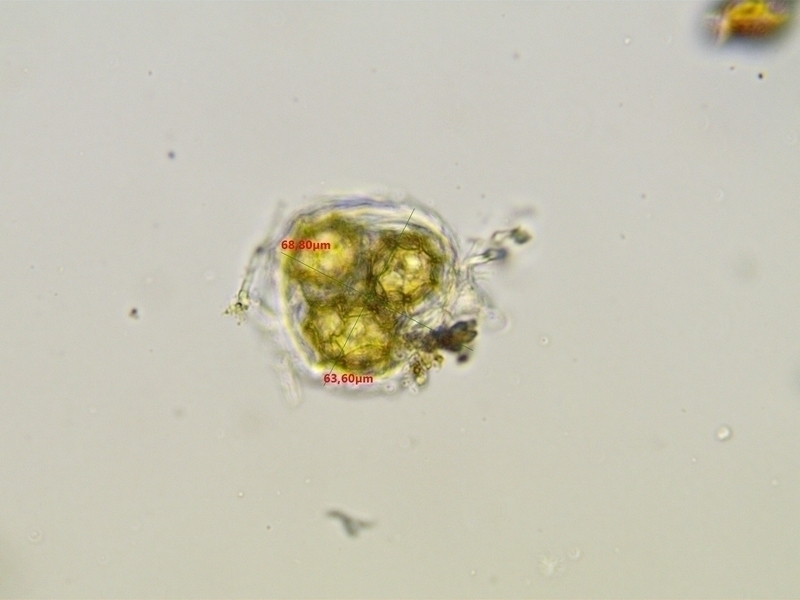
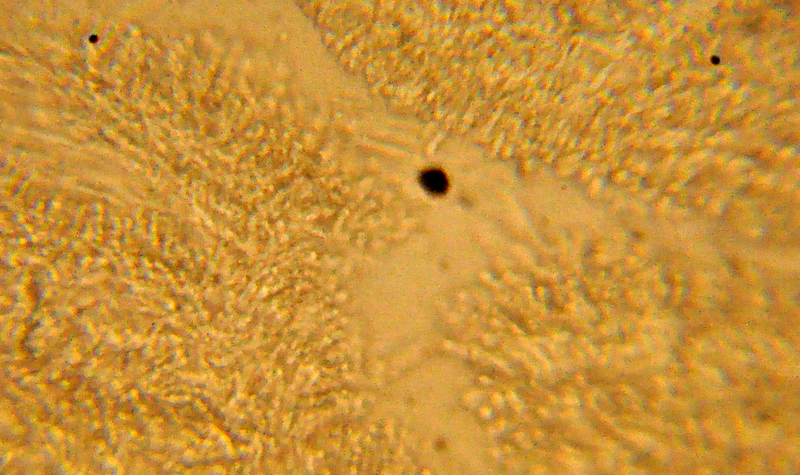
Pierwszy oznaczony przeze mnie mikroskopowo grzyb.
Tuber bellonae - po kluczu Pani Profesor Ławrynowicz
Zdjęcie zrobione z ręki komórką (czekam na profesjonalną kamerę z oprogramowaniem do pomiarów).
Zacząłem z Hebelomą
Hebeloma z dzisiaj, z ogrodu Waldka spod świerka.
Ciąłem blaszki, ostrza blaszek aż wióra leciały - 2 godziny.
Były zarodniki, były cheliocystydy i ... co z tego?
Preparat wysechł mi po kilku minutach i nic juz widać nie było.... zanim przyłożyłem aparat... bez szans... później próby z komórką... bez szans... nie zrobiłem zdjęcia.
Dlatego wytargałem truflę z szuflady, przyciąłem, namoczyłem w roztworze 5% KOH, żeby zmiękła - pewnie dlatego takie żółte na fotce te zarodniki?
Jeszcze pytanie mam z prośbą o odpowiedz:
czy najpierw dajemy płyn na szkiełko podstawowe i na to eksykat, czy odwrotnie, najpierw eksykat a później kropla płynu?
I drugie ... do Hebelomy... Przy powiększeniu x 100 - widziałem już cheliocystydy, podstawki i maleńkie zarodniki?
przy x 400 - powinno być widać już istotne do oznaczenia szczegóły? Bo trochę małe to wszystko dla mnie?
x 1000 - czego tutaj szukamy?
Pierwsze wrażenia.
Super!
Chociaż, ustawienia mam nie do końca optymalne, brakuje mi ostrości, brakuję głębi... obraz mi się rozmywa... ciężko...
Kuwa... BARDZO CIĘŻKO!