Marcinie, chętnie pociągnąłbym z Tobą ten temat udzielając wskazówek co i jak po kolei ale wolałbym nie w tym przypadku.
Już wyjaśniam dlaczego.
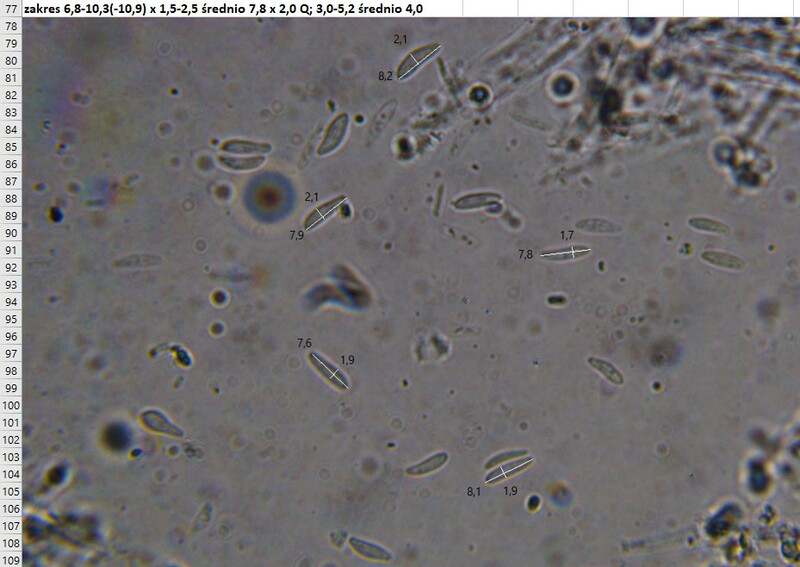
Mollisia jest cholernie trudna, chyba, że trafi się na dosłownie kilka gatunków z tego rodzaju ktore w miarę wydają się być łatwe. Trzeba stracić sporo czasu na dokładne badania a szczególnie jak nie wie się jak do tego zabrać się. Możliwe, że jest to ten domniemany gatunek ale z doświadczenia wiem, że zimowe zbiory są jeszcze trudniejsze do badania. Owocniki byc może kilkakrotnie podmrażane przez co cechy nie muszą być klarowne ... bardzo częsty przypadek dlatego nie chciałbym niepotrzebnie tracić Twego i mojego czasu. Jeśli chcesz oczywiście podpowiem czego brakuje w Twojej dokumentacji i jak to zrobić ale może innym razem jak znajdziesz jakąś bogatą kolekcję w okresie bardziej przyjaznej aury.
Musisz liczyć się z tym, że bardzo często spotyka się kolekcje przy których nawet pomimo pełnej dokumentacji gatunek nie został określony a to dlatego, że rodzaj potwornie niedopracowany.
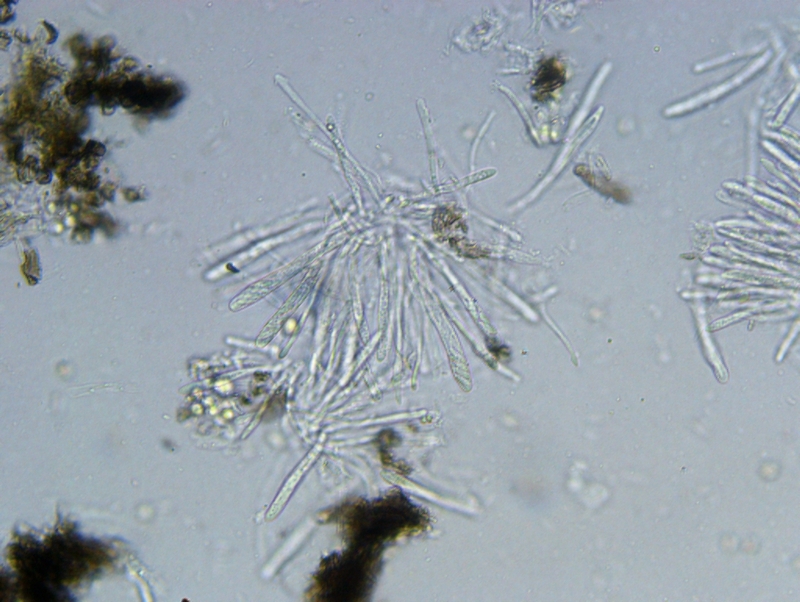
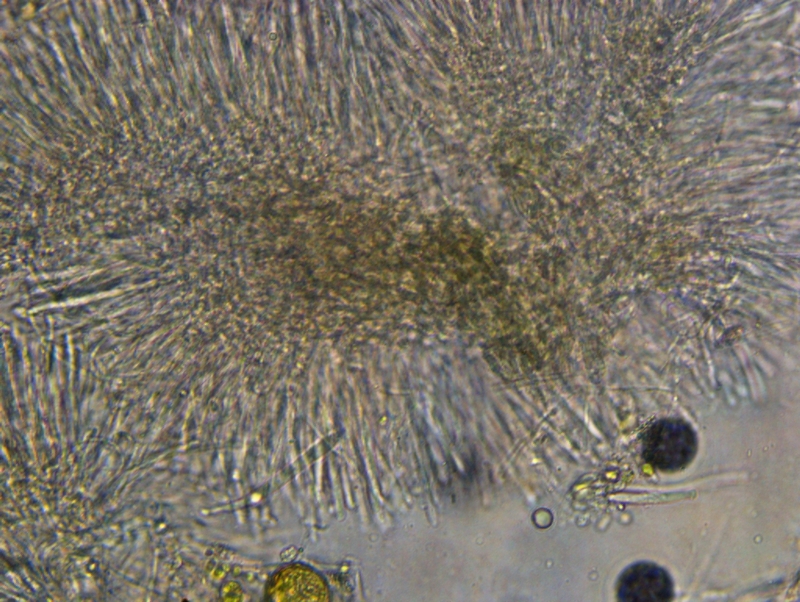
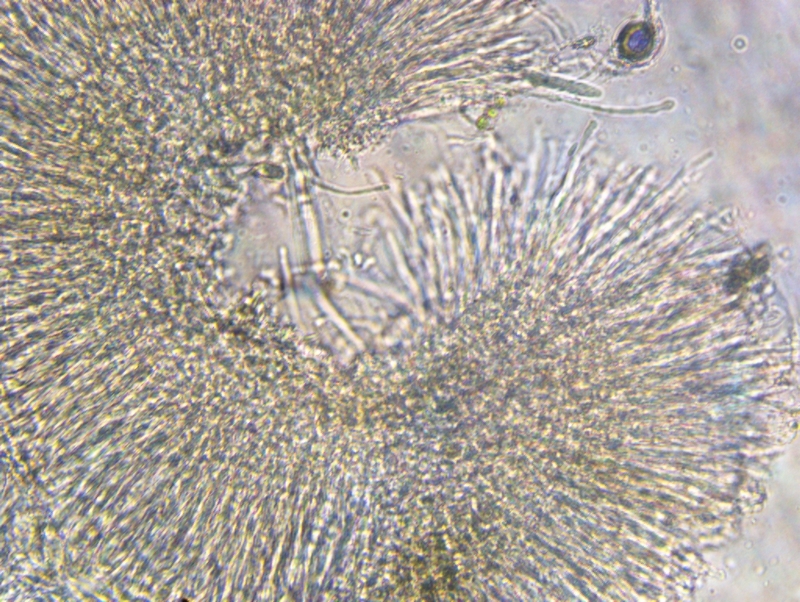
Inne rodzaje z resztą też więc w między czasie poćwicz przekroje na małych asco bo od tego trzeba zaczynać. Przekrój musi być tak cienki aby było widać wyraźnie wszystkie warstwy z możliwością określenia tekstur jak i też charakter komórek marginalnych.
W między czasie potrenuj może i inne czynności!
Reakcja na KOH:
Są dwa sposoby i jak mamy jakieś watpliwości najlepiej zastosować oba!
1) nakładamy na hymenium świeżego owocnika kropelkę KOH i obserwujemy zmian,e barwy.
2) nanosimy kropelkę KOH na szkiełko podstawkowe, następnie pobieramy mały fragment owocnika, za pomocą igły przenosimy i nakładamy na środek kropli KOH i natychmiast pod mikroskop.
W mniejszym powiększeniu oglądamy czy wokół fragmentu owocnika nie tworzy się żółta otoczka.
Do tego badania szkiełka nakrywkowego nie używamy!!!
Reakcja IKI
Jak nie możesz jej zaobserwować to potraktuj próbkę najpierw KOH wg, schematu:
KOH >>> H2O co najmniej kilka razy >>> IKI
Szkiełka nie zdejmujesz ani zbytnio nie unosisz. KOH nakłądasz normalnie i do tego próbka, osuszasz ręcznikiem papierowym delikatnie przyłożonym z góry i chwilę trzymając, wyssie medium spod szkiełka.
Kroplę wody nakładasz na szkiełko podstawkowe przy krawędzi szkiełka nakrywkowego, woda powinna być samoczynnie zassana pod szkiełko, jęśli nie to bardzo, ale to bardzo delikatnie unieś róg szkiełka ze strony gdzie nałozyłęś kroplę. Czynnośc do powtórzenia kilkakrotnie aż na koniec kropla IKI i obserwujesz reakcję.
Myślę, że dwie trzy próby i dojdziesz do profesjonalizmu.