#1472
od maja 2002
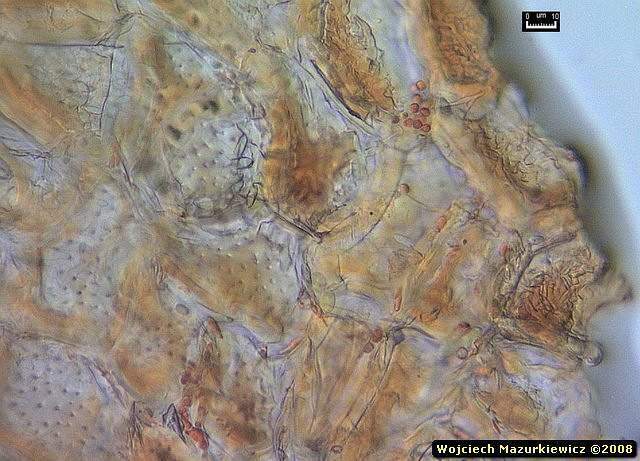
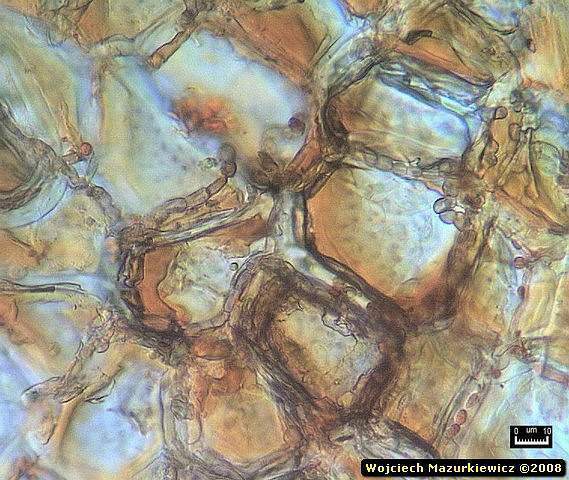
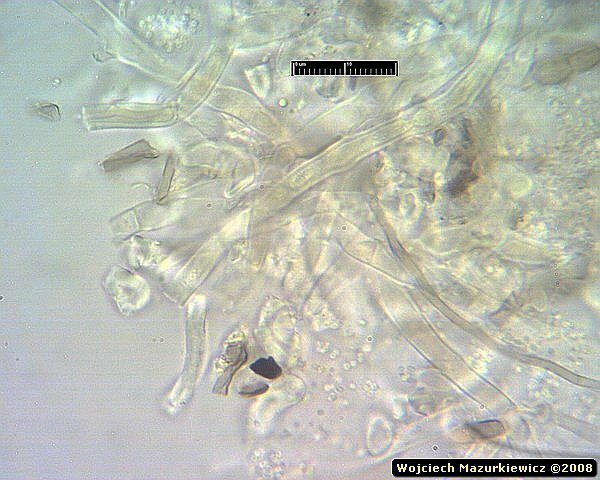
Prawdopodobnie mamy tutaj do czynienia ze starym owocnikiem Phanerocheate sanguinea. Ten gatunek począttkowo biało-kremowy, z wiekiem lub uszkodzony staje się taki jak na zdjęciu, a ponadto charakterystycznie przebarwia drewno, na czerwono.
Dzięki Darku - dzisiaj go jeszcze wezmę pod mikroskop i wrzucę zdjęcia.

#1480
od maja 2002
Te zdjęcia to ładne kolaże ale nie zawierają żadnej informacji na temat grzyba, no, może widac tam łańcuszki konidiów jakiejś anamorfy ale nic więcej.
Więc:
- albo wykonałeś preparat w niewłaściwy sposób
- albo to w ogóle nie jest grzyb
Zakładam, że nie masz do dyspozycji lupy (mikroskopu stereoskopowego), żeby wykonac precyzyjny przekrój owocnika (jeśli to grzyb).
Proponuję zatem, żebyś spróbował jeszce raz pobierając bardzo mały kawałek z samego brzegu, wygląda na włóknisty - pobierz igłą preparacyjną (może być najcieńsza igła do szycia jaką znajdziesz). Jak masz zwykłą lupę to możesz sobie nią pomóc dla większej precyzji. Zamocz igłę w wodzie lub KOH i weź tyle włokienek z brzegu ile zmieści Ci się na czubek igły; tyle ile się do czubka igły przylepi i nie bedzie spadać. Przenieś do kropli na szkiełku (mam nadzieję, że będzie to kropla KOH 3-5%, a nie kropla wody). Zatop pobrane fragmenty tak, żeby zanurzyły się w płynie i opadły na dno kropli, zaległy na szkiełku. Jeśli będą pływać po powierzchni kropli podczas przykrywania szkiełkiem nakrywkowym to po pierwsze będą uciekać spod szkiełka, a co jeszce bardziej przykre nabiorą powietrza, które potem znacznie utrudni obserwację.
Jak nakryjesz "zatopione" skrawki to widokpowinien być lepszy.
Może dzięki temu zobaczymy czy tam w ogóle są jakieś strzępki.

#588
od lutego 2007
OK Darku - wielkie dzięki za informację. Jutro się za niego jeszcze raz zabiorę. Jak opisałeś powyżej to w 100% źle zrobiłem preparat. Ja po prostu zeskrobałem kawałek tego czerwonego i wrzuciłem pod mikroskop (no cóż jestem jeszcze laik - długi czas nauki przede mną ). Wczoraj byłem u Ani.K. i ona mi przekazała wiele cennych informacji na temat robienia preparatów i jak je rozumieć (oczywiście to tylko jedna milionowa informacji jakie Ania posiada, ale jak dla mnie to na jeden raz wystarczająco dużo). Tak więc jak tylko przygotuje preparat według Twoich wskazówek to zaraz wrzucę na forum.

#1484
od maja 2002
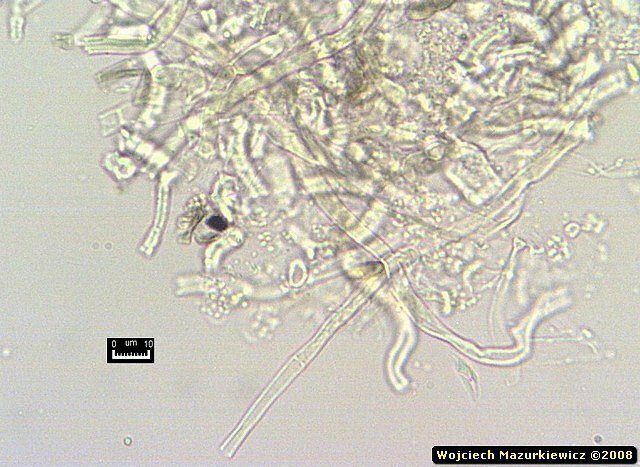
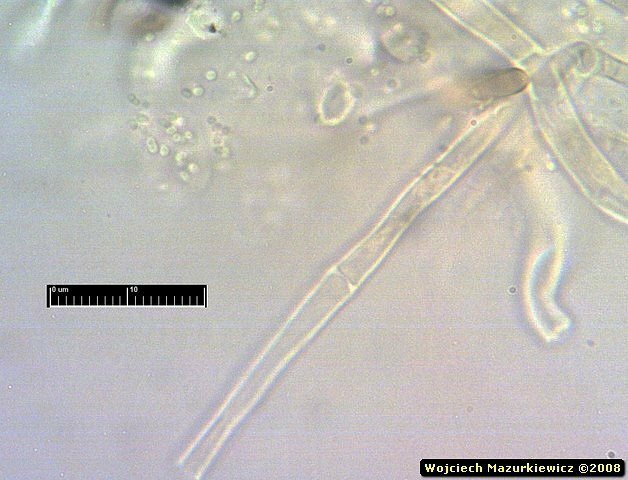
Bravo!
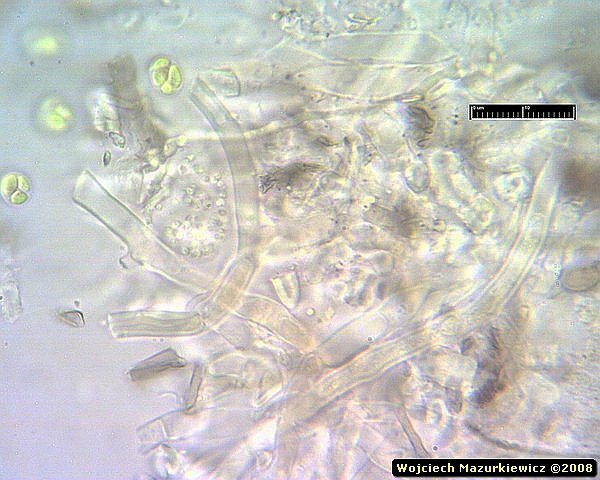
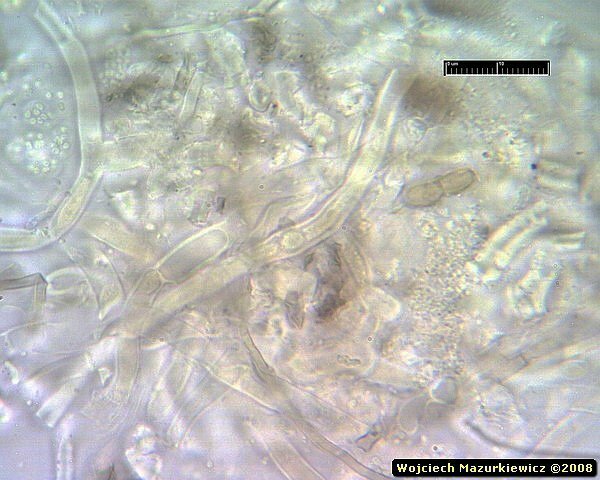
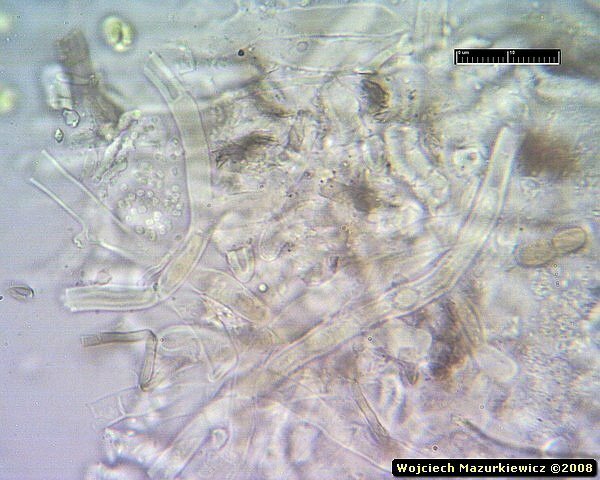
Z chaosu zaczęło się coś wyłaniać :-) Jest to krok milowy w stosunku do pierwszego preparatu.
Widać, że są tam jakieś strzępki - o zgrubiałych ścianach, septowane, bez sprzążek. Na tej podstawie nie można jeszcze jednoznacznie stwierdzić, że jest to Phanerochaete sanguinea, ale wiemy już, że to jest grzyb, a rodzaj strzępek generalnie pasuje do Phanerochaete.
W rodzaju Phanerocheate w zasadzie nie ma sprzążek, jednak, żeby nie było tak łatwo są wyjątki - na niektórych strzępkach w subikulum P. sanguinea (i np. P. laevis) sprzążki są obecne - takie specjalne, parzyste (dwie przy jednej sepcie) lub okółkowe (cztery lub więcej przy sepcie).
Nie ma jednak sensu specjalnie ich szukać.
Warto natomiast poszukac cystyd w hymenium i zaobserwować i zmierzyć zarodniki.
Ania na pewno udzieliła Ci szczegółowych wyjaśnień jak to robić więc po prostu poćwicz to! Czekam na efekty.

#594
od lutego 2007
Dzięki Darku - będę dalej walczył z tym grzybkiem. Może coś mi wyjdzie. Darku temat poszukiwania cystyd i zarodników w tapetach niestety nie dostałem wykładu od Ani. Wydaje mi się, że Ty jesteś w tym naszym "guru". Darku w związku z tym mam pytanie. Gdzie najlepiej pobrać próbkę grzyba pod mikroskop z takiej malutkiej tapety, aby znaleźć cystydy i zarodniki ?

#1488
od maja 2002
Z tym "guru" to prosze nie przesadzać !
Co do miejsca pobrania fragmentu to jest pełna dowolność. Najlepiej wybierz takie miejsce w środku owocnika, które wygląda na najlepiej zachowane, nie jest pogniecione w transporcie czy dotykane.
Bez pomocy mikroskopu stereoskopowego precyzyjny i dobry (czytelny) preparat z farby jest wykonać bardzo trudno.
Możesz użyć opisanej poprzednio metody z igła preparacyjną i pobrać bardzo mały kawałek z powierzchni owocnika - zasada jest prosta - im mniej tym lepiej. Najlepszy będzie fragmencik na pograniczu widoczności.
Możesz też zrobić próbę z żyletką. W wytypowanym, dobrze zachowanym miejscu robisz jedno nacięcie, a następnie drugim cięciem odkrawasz plasterek owocnika tak cienki jak tylko ci się uda. Potem taki plasterek (powiedzmy, że ma on długość około 0,5-1 mm i grubość 0,1 mm i wysokość równą grubości owocnika) układasz na szkiełku podstawowym jak plaster kiełasy na kromkę :-), kapiesz na niego kropelką KOH i po zadbaniu o to, żeby zatopił się i zaległ na szkiełku przykrywasz szkiełkiem nakrywkowym.
Jeśli po wstępnej obserwacji nie zobaczysz nic ciekawego z powodu zbyt grubego preparatu to możesz ten preparat "rozplaszczyć" dociskając szkiełko nakrywkowe i jeszcze raz spróbować obserwować. Płyn który wypłynie spod szkiełka przy dociskaniu odciągnij chusteczką, żeby nie zapaprał ci obiektywów.
Możesz również przeciąć cały patyk z owocnikiem wzdłuż osi tak, żeby owocnik znalazł sie w dwóch kawałkach. Wtedy z jednego kawałka łatwo będzie odciąć plasterek z przekrojem owocnika z jak najmniejszą ilością drewna i taki plaster ułozyć na szkiełku.
W końcu można także w pierwszym kroku odciąć płaski kawałek drewna z fragmentem owocnika (jak heblem czyli równolegle do powierzchni drewna i powierzchni owocnika), a w następnym kroku z takiego "rzozu" odcinać plasterki, aż do uzyskania zadowalająco cienkiego przekroju owocnika.
Uf...

#604
od lutego 2007
Dzięki Darku za informację dotyczącą pobierania fragmentu tapety do mikroskopowania. Mam jeszcze jedno (może głupie pytanie). Ania mi powiedziała, że ona stosuje wodny roztwór amoniaku (taki od niej otrzymałem) do zalewania preparatu zamiast KOH. Czy w przypadku tapet też istnieje dowolność stosowania tych odczynników ? Czy koniecznie trzeba stosować 10% KOH ? Nie ma to dla mnie znaczenia bo mam obydwa.

#1489
od maja 2002
10% KOH to jest zdecydownie za mocne!!! Może mieć niszczące działanie na struktury. Kryształy na strzępkach i cystydach (obecne w niektórych gatunkach) będą się gwałtownie rozpuszczać; żywicowate wydzieliny z cystyd będą błyskawicznie zamieniać się w wirująca i zaciemniającą obraz preparatu masę upierdliwych kuleczek itd.
Powinien być 3-5% roztwór, nie silniejszy. Rozcieńcz!
Ponieważ w litereaturze zawsze polecają KOH i z nim (między innymi) związane są różne reakcje barwne podkreślane jako charakterystyczne w opisach, to zawsze trzymałem się KOH - nigdy nie stosowałem wody amoniakalnej zwanej dawniej wodorotlenkiem amonu (NH4OH). To też zasada (no, ma odczyn zasadowy) więc pewnie efekty działania podobne. Możesz poeksperymentować. Skoro Ania poleca to na pewno bedzie OK.
Dzięki Darku za kolejną lekcję. Jutro może znajdę czas to sporządzę 3% KOH i zabiorę się za tego grzybka.
NH4OH stosuję do blaszaków - jest zamiennikiem KOH i wolę go od KOH. W przypadku "hubowatych" wszelkiego rodzaju - nie mam dużego doświadczenia, a NH4OH sprawdzło się do tej pory nieźle.
Mam KOH 10% do reakcji barwnych na świeżych owocnikach (blaszaków ...), natomiast do mikroskopowania kropla KOH + dwie krople wody daje pożądany roztwór "od ręki".
NH4OH jest dla mnie wygodniejszy bo zabarwia też cystydy u Inocybe na żółto (w częśći wypadków), jest stosowany w sprawdzaniu "reakcji amoniakalnej" u Conocybe, ładnie (ale KOH też) wybarwia chryzocystydy u Stropharia i pokrewnych. Dla mnie jest trochę uniwersalniejszy, dlatego wolę amoniak. Na amoniaku mam też czerwien kongo.
Nie wiem na ile jest dobrym zamiennikiem dla farb i tapet.

#612
od lutego 2007
No i znowu kawałek fajnej lekcji dotyczącej używania odczynników pod mikroskopem - dzięki Aniu. Rozumiem, że mogę sobie rozcieńczyć 10% KOH w stosunku 1 część KOH i 2 części H2O i otrzymam pożądany roztwór KOH do badań mikroskopowych (ok 3,3% KOH) - czy tak? Poza tym rozumiem, że stosować 10% KOH na świeże owocniki (blaszaki), a NH4OH do ich badania. Co do tapet Darek napisał 3-5% KOH i tego będę się trzymać. Jeszcze jedno pytanie w tym temacie, rozumiem, że mogę sobie przygotować z tej wody amoniakalnej - barwny jego roztwór. Ile należy dodać barwnika (czerwieni kongo) do wody amoniakalnej - jaki to jest stosunek aby roztwór prawidłowo barwił preparat?
Sprawdziłem w odczynnikach to mam od Ciebie już gotowy roztwór czerwieni kongo na amoniaku.