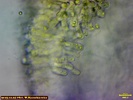
żółty gołąbek z lasu sosnowego ?
To gąska raczej.
Ale on miał smak gołąbka (po paru minutach lekko piekący). Poza tym nie przypomina mi żadnej znanej gąski o tym kolorze. Można by podejrzewać T. sejunctum, u mnie rośnie jej bardzo dużo (opatrzyłem się z nią) i raczej ją wykluczam. Pozostaje z żółtych jeszcze siarkowa - lecz brak odurzającego zapachu odrzuca i ją. Ta miała zapach przyjemny. Trzon tego grzyba kruchy i mało zbity. Czy nie przypomina Russula claroflava lub R. felea?
(wypowiedź edytowana przez gaborson 23. listopada. 2015)
(wypowiedź edytowana przez gaborson 23. listopada. 2015)
Myślę, że trzeba go wrzucić pod mikroskop. Jak zarodniki będą elipsoidalne, o powierzchni brodawkowato-siateczkowatej to będzie prawdopodobnie jakiś gołąbek, a jak zarodniki będą gładkie to trzeba szukać w gąskach. Chociaż rodzinę się ustali. Dzisiaj wrzucę pod szkiełko.
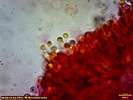

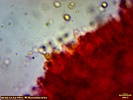
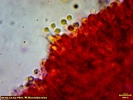
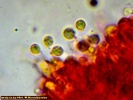



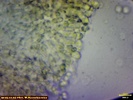
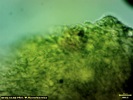
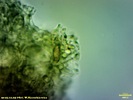
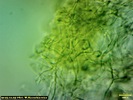
Wygląda na to, że to jednak jakaś Russula. Wrzuciłem kawałeczek pod szkiełko i wyszły zarodniki wielkości średniej 4, 77 x 4, 26 µm i wyrażnie urzeźbione z małym dzióbkiem. Słaby jestem w te klocki i dopiero rozpoczynam zabawę z mikroskopem. Dlatego prośba do "GURU" Ali, aby spojrzała na fotki poniżej to może coś wyczyta z tych moich wypocin. Preparat zrobiony w NH4OH i podbarwiony red kongo.

Mirek ja patrzę na Twoje zdjęcie to widzę gąskę T. sejunctum. Kolor Tojego owocnika znacznie odbiega od mojego. U mojego był cytrynowo żółty. Ala napisała, że to nie gołąbek więc szukajmy rozwiązania w gąskach jak napisał Tomek. Może ktoś podsunie jednak pomysł, jaka to mogłaby być gąska. T. sejunctum ma zarodniki wielkości 4, 8-7 x 4, 3-5, 6 (rysunek poniżej). Moje prawie do tych wielkości pasują (troszkę mniejsze - może być błąd pomiaru), ale posiadają urzeźbienie (chyba, że się mylę i to co widzę jest czymś innym). Również T. sulphureum ma inne zarodniki (Zarodniki cytrynowate, gładkie, 9-12 x 5-6 µm) czyli zdecydowanie większe oraz nie ma białych blaszek jak mój grzyb. Czy to dziwna T. sejunctum?
Ja się na gąskach nie znam, ale dla ostatecznego rozwiania wątpliwości zetnij kawalątek skórki i obejrzyj, jeśli strzępki będą podobne do serdelków, to potwierdzi to gąskę. To co wydaje się urzeźbieniem zarodników, to mogą być krople oleju.
Rozumiem Alu, że Rusulla nie posiada "serdelek". Ten kawałek skórki to z dowolnego miejsca kapelusza?
Z dowolnego, może łatwiej będzie oderwać (bez miąższu) z krawędzi, trzeba pobróbować. U gołąbków skórka jest w formie trichoderm, czyli sterczące pionowo strzępki, a u gąsek raczej cutis, czyli poziome serdelki, węższe lub szersze, czasem przechodząca w trichoderm. Mam na myśli epicutis, czyli tę najbardziej wierzchnią warstwę.
OK dzięki za info. Dzisiaj po pracy spróbuję zdjąć kawałek skórki i wrzucić pod szkiełko. Pytanie dodatkowe (na razie raczkuję). Czy barwić preparat red kongo dla lepszej widoczności?
A ja bym chętnie obejrzał preparat z ostrza blaszki.
Bez barwienia powinno być widać, ale jak to mówią, jak Frania woli;)
Tomku spróbuję zrobić preparat z ostrza blaszki. Nie wiem czy mi się uda. Tomku barwić czerwienią kongo?
(wypowiedź edytowana przez gaborson 24. listopada. 2015)
(wypowiedź edytowana przez gaborson 24. listopada. 2015)
(wypowiedź edytowana przez gaborson 24. listopada. 2015)
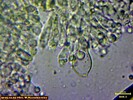
Wojtek, niestety w pierwszej serii zdjęć zaplątała się trama z kawałkiem blaszki, nie widać skórki, ale widac podstawki i chyba cystydy?
A co Ci nawala w podświetleniu?
(wypowiedź edytowana przez wink 24. listopada. 2015)
Moduł led podświetlający preparat. Zaczął wariować. Świeci raz jasno raz ciemno czyli mruga. W weekend wymienię moduł na nowy. Nie wiem jak to się stało, ale ciełem preparat z góry kapelusza. Dzisiaj spróbuję jeszcze raz. Pytanie dodatkowe bo nie wiem czy dobrze rozumiem. Jak zetnę wierzch kapelusza (kawałeczek) to na szkiełko kładę je tak jak ściąłem, czyli w poziomie. Potem dodaję kroplę KOH i czekam aż zmięknie. Potem przykrywam szkiełkiem, dociskam i pod mikroskop. Czy tak ma to wyglądać?
Mi kiedyś Błażej polecił coś takiego: "przekrój pionowy przez skórkę kapelusza + pomiar szerokości elementów najbardziej wierzchniej warstwy"
Tam chodziło jeszcze o pomiar, ale "przekrój pionowy przez skórkę kapelusza" to chyba to, o co Tobie chodzi?
To było tu: [bf#737742]
OK. Teraz wiem, że źle robiłem. Kapelusz trzeba kroić pionowo a nie zdzierać z niego skórkę poziomo. Dzisiaj spróbuję na moim fiksującym sprzęcie wykrzesać nowy preparat ze skórki.
Dzięki Basiu za linka.

Samą skórkę łatwiej pokroić niż kapelusz, mogę Ci napisać jak ja to robię. W zależności od tego z której części kapelusza jest potrzebna skórka, to z krawędzi zdzieram kawałek, z innej części jak się da, to nacinam i staram się podważyć aby zedrzeć bez miąższu, jeśli się nie uda bez, to potem zeskrobuję delikatnie miąższ skalpelem. Potem ten kawałek skórki tnę na cienkie paski i to jest to co jest mi potrzebne do obserwacji skórki. Tak to wygląda (mój roboczy talerzyk do sekcji);)
edit: no i oczywiście wycięty pasek skórki dzielę na mniejsze, bo ten jest za duży
(wypowiedź edytowana przez wink 25. listopada. 2015)
No i mamy super naukę:-) jasne, że można zdjąć skórkę, a jeszcze jak pisze Ala, oskrobać ją, a potem ciąć pionowo:-)))
Mądrych to dorze posłuchać :)

Hmmm, właściwie to zbyt wiele nie wyczytam, tu trzeba prawdziwego specjalisty, ale wydaje mi się (??), że widzę sprzążki, ale raczej nie ma na zdjęciach wierzchniej warstwy skórki, tylko głębsza wraz z tramą, ale podkreślam, że tak mi się wydaje
Wojtek, nie chcę Cię absolutnie zniechęcać, a wręcz przeciwnie, ale chyba jeszcze trzeba popracować nad materiałem. Masz KOH?
To że trzeba popracować ja doskonale wiem. Na razie to zarodniki mi jako tako wychodzą. Dopiero zaczynam się uczyć. Największy problem to zrobić odpowiedni preparat z określonego miejsca. Próbowałem zrobić go jak pisałaś, ale ten grzyb jest taki suchy, że cały mi się kruszy. Nie wiem czy nie lepiej by było go najpierw namoczyć w NH4OH a potem kroić te cienkie paseczki. Mam pozostałe śladowe ilości NH4OH, MELZER, RED KONGO (na NH4OH) oraz Błekit też na NH4OH.
Spróbuję jeszcze raz zrobić preparat wpierw go mocząc w NH4OH a potem zrobię cięcie dla preparatu. Zobaczymy co wyjdzie.
Ototo, namocz i potnij, tylko spróbuj na ile to możliwe pozbawić skórkę miąższu (no i górą na szkiełko). To samo możesz jeszcze raz zrobić z ostrzem blaszki, łatwiej Ci będzie po namoczeniu uciąć cienki skrawek z samej krawędzi. W każdym razie ja trzymam kciuki i z całej mocy wierzę, że z czasem będzie dobrze a nawet bardzo dobrze :)
Cały czas walczę ze światłem. Czekam na dostawę, aby podmienić podświetlenie preparatu.
Teraz znacznie lepiej widać równoległe serdelkowate strzępki, takie jak są m. in. w Tricholoma, ale sprzążek nie widzę, więc być może wcześniej to było złudzenie optyczne. Dobra robota, ja w kwestii oznaczenia nie pomogę, bo się nie znam, ale co do mikro pytaj do woli, jeśli tylko będę mogła, to napiszę :)
Tak, połączenia=septy, ale bez sprzążek. Sprzążki (clamp connections > grafika google) to takie bułkowate twory na wysokości przegrody (septy), wydawało mi się, co zresztą zaznaczyłam wcześniej na Twoich zdjęciach, że to one, ale jednak kolejne zdjęcia pokazują, że tylko mi się wydawało.
Ale nie ma tego złego, można szukać wśród żółtych gąsek, gdzie w skórce nie ma sprzążek w strzępkach, dużo ich nie ma;)
edit:
Wojtek, znasz angielski? mogę Ci przesłać bardzo fajną pozycję 'How to identify mushrooms to genus III: Microscopic Features'.
Napisana w bardzo przystępny sposób, prostym językiem, dużo można przyswoić.
(wypowiedź edytowana przez wink 26. listopada. 2015)
Ano, i to jest piękne w grzybach, że czasem w dużych bólach dochodzi się do celu, ale satysfakcja ogromna :)
edit: Wojtek, nie ma lekko, to teraz zrób to samo z blaszką, namocz w NH4OH i utnij cieniutki pasek z ostrza, powinny być całkiem ładne cystydy :)
(wypowiedź edytowana przez wink 26. listopada. 2015)
Alu, prześlesz mi też?:-)
Poza tym jestem bardzo ciekawy, jakie macie techniki przygotowywania preparatu z kruchego suszka, np. jak wykroić ostrze. Ja moczę, ale... efekty raczej słabe, sami nieraz widzicie.
Alu nie zauważyłem dopiski w sprawie pozycji "How to identify mushrooms to genus III: Microscopic Features". Bardzo proszę (pleaseeeeee).
Przesłane. Jak ktoś jeszcze chce, to niech się zgłasza :)
Krzysiu, od samego początku kroiłam jak umiałam, ale dopiero z czasem udawało mi się to robić w miarę sprawnie, nie moczyłam suchego materiału, kroiłam suszki. Czasem używam lupy, ale jest to bardzo niewygodne, no bo tylko dwie ręce, nawet miałam w planach kupić sobie takie stojące ustrojstwo z regulowaną pozycją lupy, ale zrezygnowałam (jedną naoczną/ okularową nawet nabyłam, ale odesłałam, bo nie spełniła oczekiwań). Tak więc u mnie wygląda to tak, że czasem wręcz tnę po omacku i zazwyczaj wtedy wychodzi najcieniej. Oczywiście marzy mi się mikroskop stereoskopowy do preparacji, ale nie mam miejsca, może kiedyś;)
Aaaa, co do samej techniki, używam igły preparacyjnej i skalpela, igłę opieram na powierzchni talerzyka 'sekcyjnego' trochę z boku materiału który chcę kroić, tak, aby na niej oprzeć skalpel i aby się stabilnie trzymał, patrzę z góry na materiał (lampka), ustawiam skalpel w miarę nisko, jednocześnie starając się nacelować na samiusieńką krawędź i ciach.
Alu dzisiaj ściągnąłem publikację. Powiem, że jest super. Bardzo dziękuję za nią. Jestem pewien (po przeczytaniu paru stron), że wiedza w niej zawarta bardzo mi się przyda w dalszej przygodzie z mikroskopem.
Z tym krojeniem suszków. To robię też tak jak Ty Alu. Moczę kawałek; namoczony przytrzymuję igłą preparacyjną a potem "ciach". Mam tylko jeden problem - słaby wzrok (wiek i praca informatyka swoje zrobiło). Te "ciach" nie zawsze wychodzi dobrze bo słabo widzącemu trudno jest trafić w namoczonego suszka. Nawet kupiłem sobie taką lupę na stojaczku, którą trochę pomaga w robieniu "ciach".
Alu, a teraz z innej beczki. Wstawiałem drugiego grzyba - czerwonego gołąbka. Napisałaś tam: "Bez mikroskopu będzie ciężko, a na R. fragilis raczej nie wygląda, a jeśli miałabym niezobowiązująco typować, to może R. aquosa?". Może tutaj bym coś spróbował wrzucić pod szkiełko. Tylko poradź co, a zaczniemy walczyć w drugim wątku z czerwonym gołąbkiem.
Cieszę się, że książeczka przypadła do gustu :)
Co do tego czerwonego gołąbka, trzeba by zobaczyć ornamentację zarodników w odczynniku Melzera oraz dokładnie je pomierzyć - najlepiej mieć wysyp, ale jeśli tego brak, można zeskrobać z blaszki. Na szkiełko ociupinka Melzera (mniej niż kropla) i ociupinka wody, płynu ma być tyle, aby za dużo się nie wylało poza szkiełko, bo wraz z nim ucieknie część zarodników. Nie lubię oglądać zarodników bezpośrednio z blaszki, bo pod setką preparat zawsze będzie za gruby, choćby był nie wiem jak cienki.
Poza zarodnikami trzeba obejrzeć skórkę (epicutis), czyli jak wyglądają dermatocystydy i włoski (w NH4OH będzie OK). Dobrze byłoby zobaczyć jak reagują dermatocystydy z sulfowaniliną, ale nie jest to konieczne. Na początek tyle wystarczy :)
Takiego czegoś to ja nie mam - sulfowanilina. Odczynnik Melzera mam. Spróbuję tak jak mówisz zeskrobać zarodniki i je dokładnie pomierzyć. Powiedz dlaczego do Melzera dodawać H2O? Jak zrobię oświetlenie w mikroskopie to spróbuję zrobić zarodniki x400 i x1000 (imersja olej). Teraz jedynie na 100x i 400x jakoś idzie, lecz ciężko. Rozumiem, że skórkę kroimy tak jak w poprzednim przypadku i nie moczymy w Melzer a NH4OH. Czy tak? Za preparaty zabiorę się pewnie jutro lub w niedzielę.
Bo w samym Melzerze zarodniki będą bardzo ciemne, ale najlepiej wypracuj sobie własny sposób metodą prób i błędów. Tak skórkę tak jak poprzednio napisałam, w NH4OH. Mnie też nie będzie do niedzieli.
Trzymamy się tematu forum. Nie drażnimy się. Ma być miło :) ⇒ szerzej o zasadach i coś jak regulamin